May our research lead to better sleep…
私たちの研究がよりよい眠りに結びつきますように
睡眠の謎を解くために これまで、そしてこれから
リガンドの同定されていないG蛋白共役型受容体のリガンドとなるペプチドを同定しオレキシンという名前をつけ、オレキシンのないマウスを調べたところオレキシンが睡眠覚醒に必須の物質であり、オレキシンの不足によってナルコレプシーという睡眠障害が生じることがわかりました。オレキシン遺伝子を欠失させることで得られたマウスの表現型を調べることによってオレキシンと睡眠がつながったわけですが、このようなアプローチを逆遺伝学 リバースジェネティクスといいます。反対に、遺伝性のある表現型から原因遺伝子の同定に進むアプローチを順遺伝学 フォワードジェネティクスといいます。フォワードジェネティクスは非常に強力なアプローチであり、神経科学、免疫学、発生学などにおいて画期的な発見をもたらし、いくつものノーベル賞の受賞理由となっています。フォワードジェネティクス研究はショウジョウバエや線虫など小さく、世代時間の短い動物が使われます。
しかし、睡眠の性質や脳の構造は哺乳類とそれ以外では大きく異なるため、人の睡眠にも繋がるような睡眠のフォワードジェネティクス研究をしようとマウスを用いて研究を遂行しています。これは世界的にも類例のない試みであり、成果をあげられるかどうかは取り組み始めた時点ではわかりませんでした。
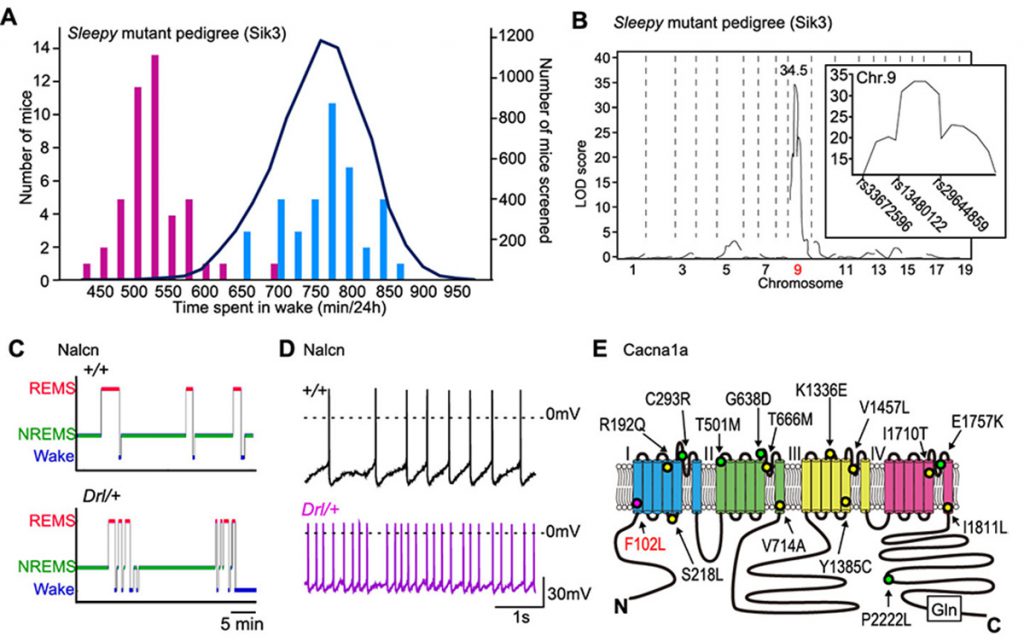
ランダムに突然変異を生じたマウスの睡眠を調べ、遺伝性に睡眠異常を示す家系を樹立し、原因遺伝子変異を同定するという地道な研究の積み重ねてきました。その結果、Sleepy, Sleepy2, Dreamless, Drowsyといった睡眠異常を示すマウス家系を樹立することができました。言い換えると、人為的に遺伝性の睡眠疾患を作り出したことになります。これらのマウス家系を調べることによってSIK3、NALCN、CACNA1Aなどの新規の睡眠制御分子を見出してきました。
しかし、睡眠制御分子がどのようにノンレム睡眠やレム睡眠を制御しているかは不明です。これら同定された分子をハブとして、睡眠制御の分子パスウェイや睡眠制御神経回路の動作機構、睡眠の気分、記憶、エネルギー代謝、老化等との関係が解明を目指して、日夜実験に取り組んでいます。研究室では、遺伝学、生化学、分子生物学、組織学、生理学、薬理学等幅広い研究手法を取り入れ、自然な睡眠覚醒を示すマウスの神経細胞の活動をありのままに観察するin vivoイメージングや脳スライスを用いたパッチクランプ法を組み合わせた実験も行われています。このような幅広い手法でアプローチをしないと睡眠を巡るミステリーを解き明かすことはできないのです。さらに、基礎研究から臨床へ応用できる研究にも力を注いでいます。
Unraveling the mystery of sleep~ past, present, and future research~
We identified a peptide that serves as a ligand for an orphan G protein-coupled receptor and named it orexin. By examining orexin-deficient mice, we found that orexin is essential for sleep/wakefulness, which led to the current understanding that a sleep disorder narcolepsy is caused by orexin deficiency. The approach to uncover the unknowns in the life sciences based on the phenotype of gene-deficient organism is called reverse genetics. Conversely, the approach that proceeds from a heritable phenotype to the identification of the causative gene is called forward genetics. Forward genetics is a very powerful approach that has led to groundbreaking discoveries in neuroscience, immunology, and embryology, some of which were the reason for Nobel Prize. Forward genetic studies typically use small, short-generation animals such as Drosophila and C. elegans.
However, since the nature of sleep and the structure of the brain differ greatly between mammals and other animals, we have been conducting forward genetic research of sleep using mice , which will lead to a better understanding of human sleep. This is an unprecedented project in the world, and we did not know at the time we started the project whether we would be able to achieve results.
We have continued to examine the sleep of randomly mutagenized mice to establish families with inherited sleep abnormalities, and to identify causative gene mutations. As a result, we were able to establish mouse pedigrees that exhibit sleep abnormalities such as Sleepy, Sleepy2, Dreamless, and Drowsy. In other words, we have succeeded in artificially creating a hereditary sleep disorder in mice. By studying these mouse pedigrees, we have discovered novel sleep-regulatory molecules such as SIK3, NALCN, and CACNA1A.
However, it is unclear how these molecules regulate non-REM and REM sleep. Based on these identified molecules, we are working on to elucidate the molecular pathways of sleep regulation, the operational mechanisms of sleep-wake regulatory neural circuits, and the relationship of sleep with mood, memory, energy metabolism, and aging. The laboratory incorporates a wide range of research methods, including genetics, biochemistry, molecular biology, histology, physiology, and pharmacology, as well as in vivo imaging to observe neuronal activity as it is in mice that exhibit spontaneous sleep-wake states, and patch-clamp experiments using brain slices. Without such a broad approach, it is impossible to unravel the mysteries of sleep. Furthermore, we also focus on translational research that can be applied from basic research to clinical sleep medicin.
睡眠の謎を解くために これまで、そしてこれから
リガンドの同定されていないG蛋白共役型受容体のリガンドとなるペプチドを同定しオレキシンという名前をつけ、オレキシンのないマウスを調べたところオレキシンが睡眠覚醒に必須の物質であり、オレキシンの不足によってナルコレプシーという睡眠障害が生じることがわかりました。オレキシン遺伝子を欠失させることで得られたマウスの表現型を調べることによってオレキシンと睡眠がつながったわけですが、このようなアプローチを逆遺伝学 リバースジェネティクスといいます。反対に、遺伝性のある表現型から原因遺伝子の同定に進むアプローチを順遺伝学 フォワードジェネティクスといいます。フォワードジェネティクスは非常に強力なアプローチであり、神経科学、免疫学、発生学などにおいて画期的な発見をもたらし、いくつものノーベル賞の受賞理由となっています。フォワードジェネティクス研究はショウジョウバエや線虫など小さく、世代時間の短い動物が使われます。
しかし、睡眠の性質や脳の構造は哺乳類とそれ以外では大きく異なるため、人の睡眠にも繋がるような睡眠のフォワードジェネティクス研究をしようとマウスを用いて研究を遂行しています。これは世界的にも類例のない試みであり、成果をあげられるかどうかは取り組み始めた時点ではわかりませんでした。
ランダムに突然変異を生じたマウスの睡眠を調べ、遺伝性に睡眠異常を示す家系を樹立し、原因遺伝子変異を同定するという地道な研究の積み重ねてきました。その結果、Sleepy, Sleepy2, Dreamless, Drowsyといった睡眠異常を示すマウス家系を樹立することができました。言い換えると、人為的に遺伝性の睡眠疾患を作り出したことになります。これらのマウス家系を調べることによってSIK3、NALCN、CACNA1Aなどの新規の睡眠制御分子を見出してきました。
しかし、睡眠制御分子がどのようにノンレム睡眠やレム睡眠を制御しているかは不明です。これら同定された分子をハブとして、睡眠制御の分子パスウェイや睡眠制御神経回路の動作機構、睡眠の気分、記憶、エネルギー代謝、老化等との関係が解明を目指して、日夜実験に取り組んでいます。研究室では、遺伝学、生化学、分子生物学、組織学、生理学、薬理学等幅広い研究手法を取り入れ、自然な睡眠覚醒を示すマウスの神経細胞の活動をありのままに観察するin vivoイメージングや脳スライスを用いたパッチクランプ法を組み合わせた実験も行われています。このような幅広い手法でアプローチをしないと睡眠を巡るミステリーを解き明かすことはできないのです。さらに、基礎研究から臨床へ応用できる研究にも力を注いでいます。
Unraveling the mystery of sleep~ past, present, and future research~
We identified a peptide that serves as a ligand for an orphan G protein-coupled receptor and named it orexin. By examining orexin-deficient mice, we found that orexin is essential for sleep/wakefulness, which led to the current understanding that a sleep disorder narcolepsy is caused by orexin deficiency. The approach to uncover the unknowns in the life sciences based on the phenotype of gene-deficient organism is called reverse genetics. Conversely, the approach that proceeds from a heritable phenotype to the identification of the causative gene is called forward genetics. Forward genetics is a very powerful approach that has led to groundbreaking discoveries in neuroscience, immunology, and embryology, some of which were the reason for Nobel Prize. Forward genetic studies typically use small, short-generation animals such as Drosophila and C. elegans.
However, since the nature of sleep and the structure of the brain differ greatly between mammals and other animals, we have been conducting forward genetic research of sleep using mice , which will lead to a better understanding of human sleep. This is an unprecedented project in the world, and we did not know at the time we started the project whether we would be able to achieve results.
We have continued to examine the sleep of randomly mutagenized mice to establish families with inherited sleep abnormalities, and to identify causative gene mutations. As a result, we were able to establish mouse pedigrees that exhibit sleep abnormalities such as Sleepy, Sleepy2, Dreamless, and Drowsy. In other words, we have succeeded in artificially creating a hereditary sleep disorder in mice. By studying these mouse pedigrees, we have discovered novel sleep-regulatory molecules such as SIK3, NALCN, and CACNA1A.
However, it is unclear how these molecules regulate non-REM and REM sleep. Based on these identified molecules, we are working on to elucidate the molecular pathways of sleep regulation, the operational mechanisms of sleep-wake regulatory neural circuits, and the relationship of sleep with mood, memory, energy metabolism, and aging. The laboratory incorporates a wide range of research methods, including genetics, biochemistry, molecular biology, histology, physiology, and pharmacology, as well as in vivo imaging to observe neuronal activity as it is in mice that exhibit spontaneous sleep-wake states, and patch-clamp experiments using brain slices. Without such a broad approach, it is impossible to unravel the mysteries of sleep. Furthermore, we also focus on translational research that can be applied from basic research to clinical sleep medicin.
